9月21日—9月27日医药行业的这些动态值得关注
封面新闻
国家药监局发布公告,决定成立第十二届药典委员会。本届药典委员会由454名委员组成,设执行委员会和29个专业委员会,国家药监局局长焦红任主任委员,2025年版《中国药典》编制工作全面启动。
行业 · 政策动态
1.国家药监局发布仿制药参比制剂目录(第五十九批),涉及异麦芽糖酐铁注射液等药品。
2.国家中医药管理局办公室、国家药监局综合和规划财务司联合印发《古代经典名方关键信息表(25首方剂)》。此次发布的25首方剂包括桃核承气汤、芍药甘草汤、半夏泻心汤等。《信息表》涵盖每首方剂出处、处方、制法及用法、药味名称、基原及用药部位、炮制规格、折算剂量、用法用量、功能主治等信息。
3.国家药监局药品审评中心就《基于人用经验的中药复方制剂新药药学研究技术指导原则(征求意见稿)》征求意见。《征求意见稿》强调了人用经验药学研究应基于中医临床实践,明确人用经验所用药物的药学关键信息,中药复方制剂新药的质量应与人用经验所用药物的质量基本一致,人用经验药学关键信息应可溯源。并明确了处方、制备工艺、剂型、质量研究及质量标准、稳定性和桥接研究等具体要求。征求意见截止日期为2022年10月26日。
4.国家药监局药品审评中心就《咀嚼片(化学药品)质量属性研究技术指导原则(征求意见稿)》公开征求意见。《征求意见稿》适用于属于常释制剂(化学药品)的咀嚼片或说明书用法项下注明可咀嚼后服用片剂的研究和开发。征求意见截止日期为2022年10月25日。
5.国家药监局药品审评中心就《治疗卵巢癌新药临床研发技术指导原则(征求意见稿)》公开征求意见。《征求意见稿》从新药临床开发的探索性阶段和确证性阶段介绍了方案设计需关注的重点问题,对治疗卵巢癌新药临床研发的技术考虑要点进行了详细阐述。征求意见截止日期为2022年10月25日。
6.国家药监局药品审评中心就《中药新药临床试验用药品的制备研究技术指导原则(征求意见稿)》公开征求意见。《征求意见稿》强调中药新药临床试验用药品应符合相关质量管理规范要求,保证试验药物质量,满足中药新药临床试验需要。并对试验药物和安慰剂的制备、质量控制要求以及包装、贮藏等方面明确了具体要求。征求意见截止日期为2022年10月26日。
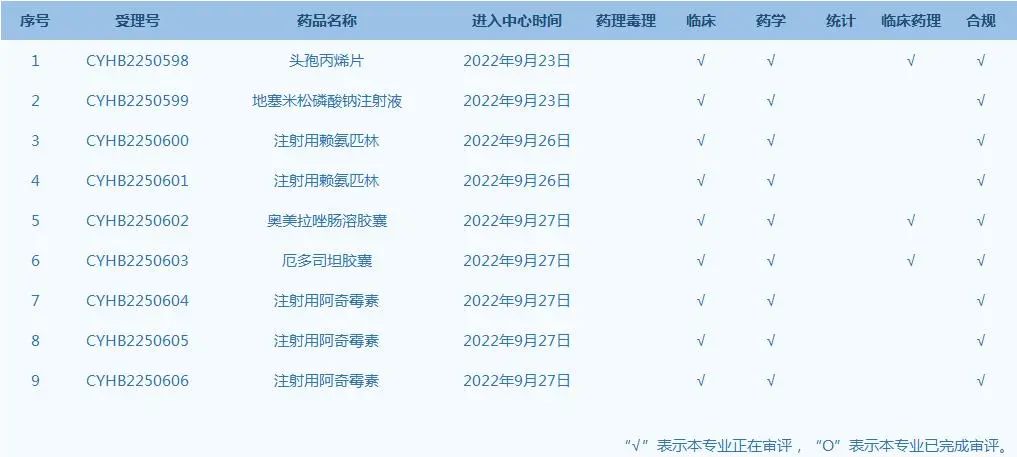
7.国家药监局药品审评中心网站公示9个仿制药一致性评价任务,涉及头孢丙烯片等药品(截至9月27日)。
产品研发 · 上市信息
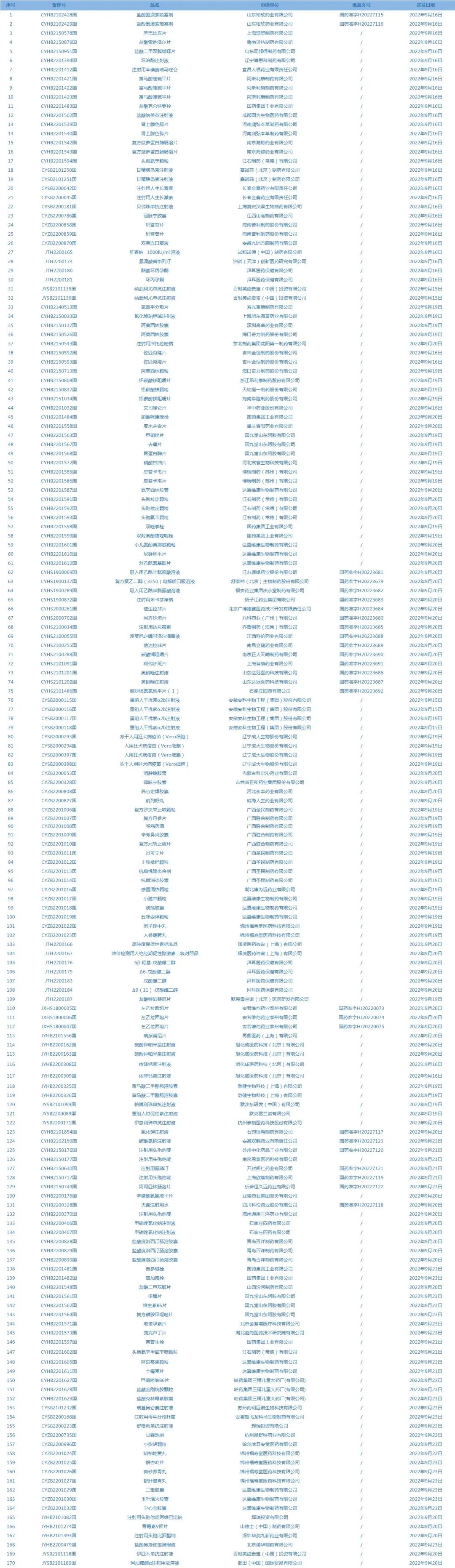
1.国家药监局发布3期药品批准证明文件待领信息,共包括170个受理号,涉及阿斯利康制药有限公司等企业(截至9月27日)。
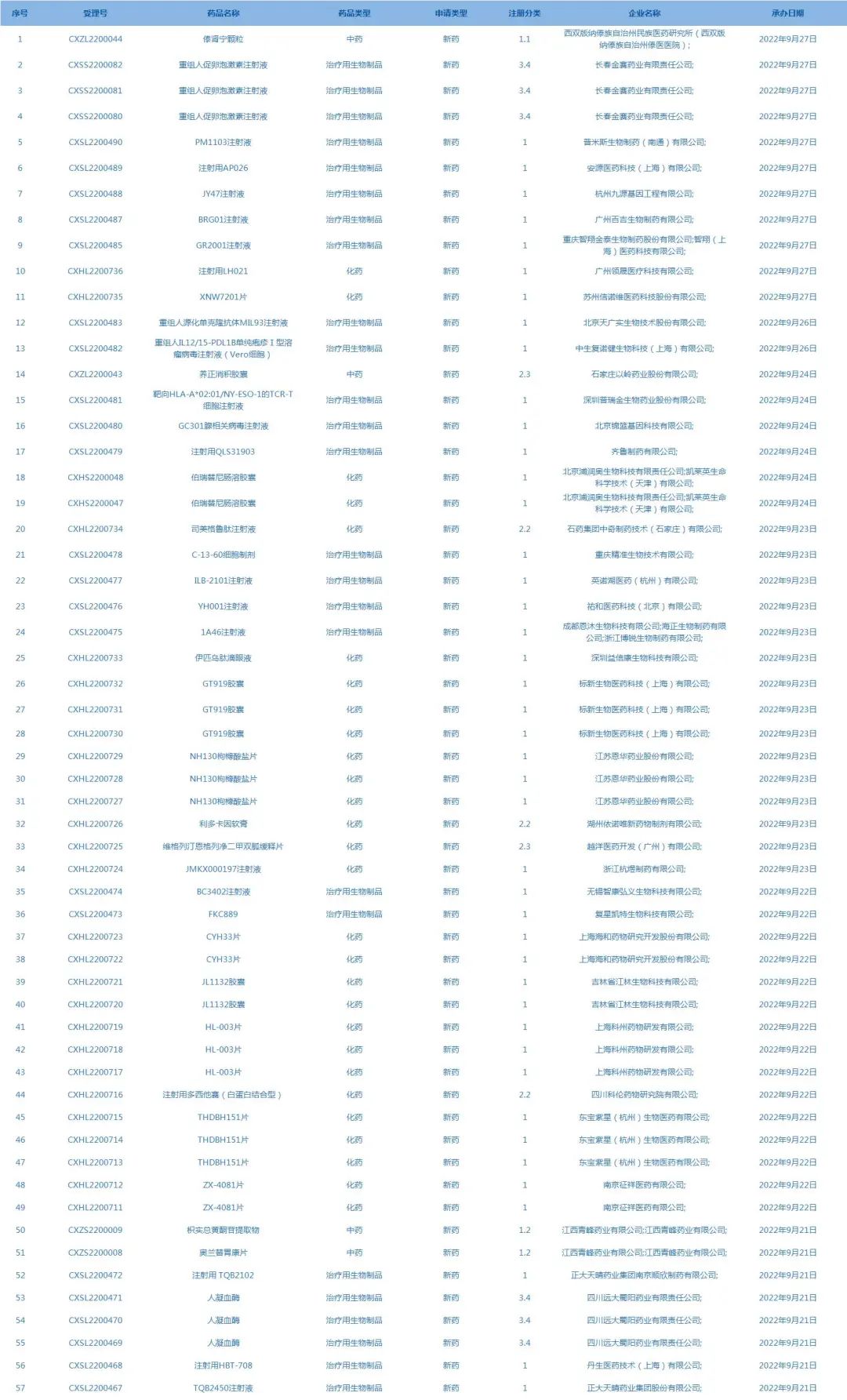
2.国家药监局药品审评中心承办受理57个新药上市申请,包括傣肾宁颗粒等药品(截至9月27日)。
3.华海药业发布公告称,收到美国食品药品管理局(FDA)的通知,公司向FDA申报的奈必洛尔缬沙坦片的新药简略申请获得批准。
4.普利制药发布公告称,收到新加坡卫生科学局(HSA)签发的注射用阿奇霉素批准通知。
医药企业观察
1.罗欣药业发布公告称,公司与上药控股有限公司就建立医药市场战略性伙伴关系事宜,达成战略合作伙伴框架协议。
2.千红制药与湖北省钟祥市人民政府签订《常州千红制药原料药生产基地项目合同书》,千红制药拟使用自有资金投资6亿元在湖北省钟祥市新建原料药生产基地项目。
3.双成药业与Meitheal Pharmaceuticals, Inc.(以下简称“Meitheal”)和Hong Kong King-Friend Industrial Co., Ltd.(以下简称“HKF”)签署《许可及供应协议》。协议约定,双成药业将研发和生产的制剂注射用紫杉醇(白蛋白结合型,100mg/瓶)在美国地区内的独家许可授予Meitheal和HKF。Meitheal负责该产品在美国地区内的市场规划及销售,产品上市后,Meitheal应向双成药业支付美国地区内产品销售产生的利润分成;HKF需向双成药业支付一定的一次性里程碑款项,总额为600万美元。
4.百诚医药发布公告,其全资子公司赛默制药拟以5亿元投资创新药物、高端复杂制剂、医美(健康)产品CMO/CDMO(合同生产/商业生产外包)及研发中心项目,建设周期为24个月。
5.恒瑞医药发布公告称,公司全资子公司上海瑞宏迪拟通过增资扩股方式引入恒瑞集团、盛迪基金、迎泰资产管理作为新股东,增资金额合计4.98亿元。
6.诺诚健华于9月21日在上海证券交易所科创板上市,发行价格为11.03元/股,开盘即破发,报10.70元/股。截至收盘,诺诚健华报9.33元/股,下跌15.41%,振幅18.04%,成交额10.82亿元。
7.四环医药宣布,旗下非全资附属公司惠升生物已完成以增资方式进行的首轮融资,投资人包括国寿大健康基金、天津远翼永宣、天津远翼吉茂、银杏资本。根据本次增资协议,上述四位投资方以5亿元人民币认购惠升生物新发行的3333.3万股的股份,共占惠升生物的股权比例为10%。
8.9月26日,健康元药业集团股份有限公司发行的全球存托凭证(GDR)在瑞士证券交易所成功上市,成为国内首家赴瑞发行GDR并成功上市的生物医药企业。
药品集中采购
1.云南省政府采购和出让中心发布《2022年云南省生物制品(生物类似物)药品挂网交易有关事宜的通知》。经审核通过的新生物制品(生物类似物),将于2022年10月17日起在云南省药品集中采购平台药品交易系统正式启用,涉及167个生物制品。通知明确,企业申报价格不高于省级采购平台全国最低实际采购价,且申报了全国最低3个省份中标(挂网)价格的药品,医疗机构可按挂网价直接采购,也可议价采购;无省级采购平台全国最低实际采购价或企业申报省级采购平台招标(挂网)价格不足3个省份的,议价采购。
2.福建省药械联合采购中心发布《福建省药品集中带量采购文件》和《关于开展福建省第三批药品集中带量采购相关药品信息填报工作的通知》,福建省正式开启第三批药品集采。本次集采涉及50个产品,其中包括地衣芽孢杆菌活菌、双歧杆菌三联活菌、重组人凝血因子 Ⅷ、重组人生长激素4个生物制剂。
3.河北省医保局发布《关于做好中药配方颗粒挂网采购和医保支付工作的通知》。通知明确,将与中药饮片对应的中药配方颗粒纳入河北省医保支付范围,按照乙类管理,个人先行自付比例全省统一确定为5%。定点医疗机构以最低挂网价格购进,可顺加15%销售。纳入医保支付范围的中药配方颗粒,按同一名称管理,不区分生产企业。自2022年11月1日起执行。
文章来源:中国食品药品网