医药 · 看点
习近平总书记指出,要发展中医药,注重用现代科学解读中医药学原理,走中西医结合的道路;国务院办公厅印发《关于全面加强药品监管能力建设的实施意见》;国家药监局发布《药物警戒质量管理规范》;河南开展跨境电子商务零售进口药品试点;第五批国家药品带量采购工作正式启动……5月8日~5月14日,医药行业的这些事情值得关注。
行业 · 政策动态
1、5月12日下午,正在河南省南阳市考察的习近平总书记先后来到医圣祠和南阳药益宝艾草制品有限公司,了解中医药发展和艾草制品产业发展情况。习近平说,过去,中华民族几千年都是靠中医药治病救人。特别是经过抗击新冠肺炎疫情、非典等重大传染病之后,我们对中医药的作用有了更深的认识。我们要发展中医药,注重用现代科学解读中医药学原理,走中西医结合的道路。
2、国务院办公厅印发《关于全面加强药品监管能力建设的实施意见》。文件明确了六个方面重点工作:完善法规和标准体系建设;提高审评能力,优化审评机制;完善检查执法体系和办案机制,强化部门协同;提高检验检测能力,完善应急管理体系;完善信息化追溯体系,提升“互联网+药品监管”应用服务水平;实施中国药品监管科学行动计划,提升监管队伍素质和监管国际化水平。
3、国家医保局、国家卫生健康委发布《关于建立完善国家医保谈判药品“双通道”管理机制的指导意见》,从分类管理、遴选药店、规范使用、完善支付政策、优化经办管理等方面,对谈判药品“双通道”管理提出了要求。
“双通道”是指通过定点医疗机构和定点零售药店两个渠道,满足谈判药品供应保障、临床使用等方面的合理需求,并同步纳入医保支付的机制。文件明确,综合考虑临床价值、患者合理的用药需求等因素,对谈判药品施行分类管理。对于临床价值高、患者急需、替代性不高的品种,要及时纳入“双通道”管理。将谈判药品“双通道”供应保障情况纳入定点医药机构协议管理范围,明确药品供应主体和责任,督促定点医疗机构按功能定位和临床需求及时配备,定点零售药店按供应能力和协议要求规范配备。各地医保部门要确定遴选标准和程序,将资质合规、管理规范、信誉良好、布局合理,并且满足对所售药品已实现电子追溯等条件的定点零售药店纳入“双通道”管理。
4、国务院同意在河南省开展跨境电子商务零售进口药品试点,试点期为自批复之日起3年。试点品种为已取得我国境内上市许可的13个非处方药,试点目录由财政部、商务部、海关总署、税务总局、市场监管总局、国家药监局等部门联合印发。对纳入试点目录的药品,按照《关于跨境电子商务零售进出口商品有关监管事宜的公告》规定的通关管理要求开展进口业务,在通关环节不验核进口药品通关单,参照执行跨境电商零售进口相关税收政策,相关交易纳入个人年度交易总额管理,适用跨境电商零售进口商品单次、年度交易限值相关规定,在交易限值内,关税税率暂设为0%,进口环节增值税、消费税暂按法定应纳税额的70%征收。
5、公安部、国家卫生健康委和国家药监局联合发布公告,决定正式整类列管合成大麻素类新精神活性物质,并新增列管氟胺酮等18种新精神活性物质。公告自2021年7月1日起施行。我国将成为全球第一个对合成大麻素类物质实行整类列管的国家。
相关主管部门将制定合成大麻素等列管新精神活性物质检验鉴定公共安全行业标准,推进基于可疑物质和谱图分析的新精神活性物质监测体系建设,建立符合中国国情的合成大麻素等新精神活性物质成瘾性和危害性快速评估体系。
6、商务部、国家中医药管理局等7部门联合印发《关于支持国家中医药服务出口基地高质量发展若干措施的通知》,从完善体制机制、创新支持政策、提升便利化水平、拓展国际合作空间、加强人才培养和激励等五方面,提出18条具体政策措施,着力完善发展环境,形成部门政策合力,支持国家中医药服务出口基地大力发展中医药服务贸易,推动中医药服务走向世界。
目前,商务部会同国家中医药管理局认定了中国中医科学院广安门医院等17家国家中医药服务出口基地。
法规/标准/技术文件/说明书制修订
1、国家药监局发布《药物警戒质量管理规范》(以下简称《规范》),自2021年12月1日起施行。《规范》共九章一百三十四条。明确药品上市许可持有人(以下简称持有人)和获准开展药物临床试验的药品注册申请人(以下简称申办者)应当建立药物警戒体系,通过体系的有效运行和维护,监测、识别、评估和控制药品不良反应及其他与用药有关的有害反应;应当基于药品安全性特征开展药物警戒活动,最大限度地降低药品安全风险,保护和促进公众健康;应当与医疗机构、药品生产企业、药品经营企业、药物临床试验机构等协同开展药物警戒活动。对持有人和申办者实施药物警戒活动作出规定,涉及质量管理、机构人员与资源、监测与报告、风险识别与评估、风险控制、临床试验期间药物警戒等方面,明确了对药物警戒体系及活动进行质量管理、不良反应信息的监测与报告、委托开展药物警戒相关工作的相关要求。
2、国家药监局发布《医疗器械分类目录动态调整工作程序》,明确《医疗器械分类目录》动态调整原则和调整种类、调整建议提出方式和材料要求及调整意见审定的工作程序等内容。文件自公布之日起实施。
3、国家药监局发布《医疗器械临床试验质量管理规范(修订草案征求意见稿)》并公开征求意见,意见反馈截止时间为5月30日。该文件对现行《医疗器械临床试验质量管理规范》(以下简称《规范》)整体框架作出调整,修订为总则、伦理委员会、医疗器械临床试验机构、研究者职责、申办者职责、临床试验方案和试验报告、多中心临床试验、记录要求、术语9章66条;文件还将体外诊断试剂临床试验质量管理要求纳入规范管理,明确了医疗器械临床试验相关方责任。
4、国家药监局发布《牙科玻璃离子水门汀注册技术审查指导原则》《柠檬酸消毒液注册技术审查指导原则》《一次性使用注射笔配套用针注册技术审查指导原则》《一次性使用无菌闭合夹注册技术审查指导原则》,分别从综述资料、研究资料、生产制造信息、产品风险分析资料、产品临床评价等方面对相关产品的注册申报资料要求进行规范指导。
5、国家药监局对消炎镇痛膏、安神补脑制剂、清开灵口服制剂三类产品的说明书予以修订。
6、国家药监局药品审评中心(CDE)发布《每日一次基础胰岛素生物类似药临床研究设计指导原则(征求意见稿)》《化学药品和治疗用生物制品说明书中儿童用药相关信息撰写的技术指导原则(征求意见稿)》《急性非静脉曲张性上消化道出血治疗药物临床试验技术指导原则(征求意见稿)》,向社会公开征求意见。
7、国家药典委公示12个中药饮片品种炮制规范草案,包括牵牛子、炒牵牛子、南五味子、醋南五味子、芡实、炒蔓荆子、青皮、山楂、青葙子、醋青皮、炒山楂、焦山楂;公示3个国家药品标准草案,包括硫酸锌、碳酸钙D3咀嚼片(Ⅱ)、碳酸钙D3咀嚼片(IV);并第二次公示大豆油(供注射用)(原料)国家药品标准草案。上述公示期均自发布之日起3个月。
8、中国食品药品检定研究院完成13个注册检验用体外诊断试剂国家标准品和参考品的研制,并对其说明书予以公示。公示的国家参考品包括:EB病毒核酸检测试剂、副流感病毒核酸检测试剂、呼吸道合胞病毒核酸检测试剂、呼吸道腺病毒核酸检测试剂、诺卡菌核酸检测试剂、黄热病毒核酸检测试剂、森林脑炎病毒核酸检测试剂、西尼罗病毒核酸检测试剂、乙型脑炎病毒核酸检测试剂、炭疽杆菌核酸检测试剂。国家标准品包括:副流感病毒核酸检测试剂、呼吸道合胞病毒核酸检测试剂、呼吸道腺病毒核酸检测试剂。
产品研发 · 上市信息
1、国家药监局发布4期药品批准证明文件待领信息,共包括258个受理号。(截至5月14日)

2、国家药监局发布5期医疗器械批准证明文件(准产)待领信息,共包括98个受理号。(截至5月14日)
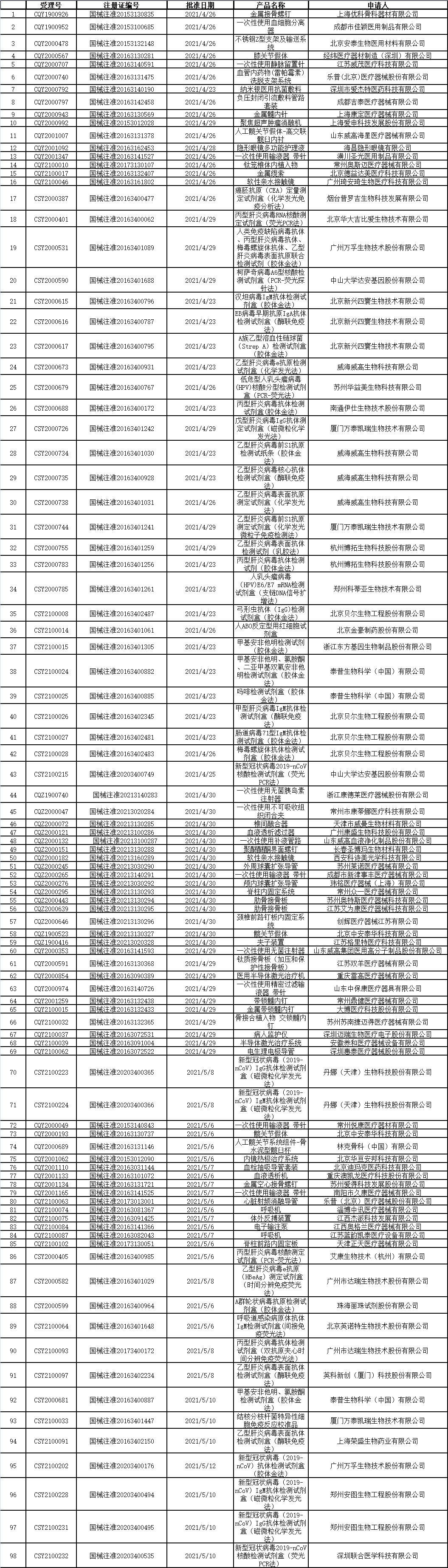
3、CDE承办受理47个新药上市申请,其中包括1.1类中药颅通胶囊,苯乙基异硫氰酸酯液体硬胶囊等1类化学药,以及派安普利单抗、泽贝妥单抗、重组人源化抗Trop2单抗-SN38偶联物片等1类治疗用生物制品。(截至5月14日)
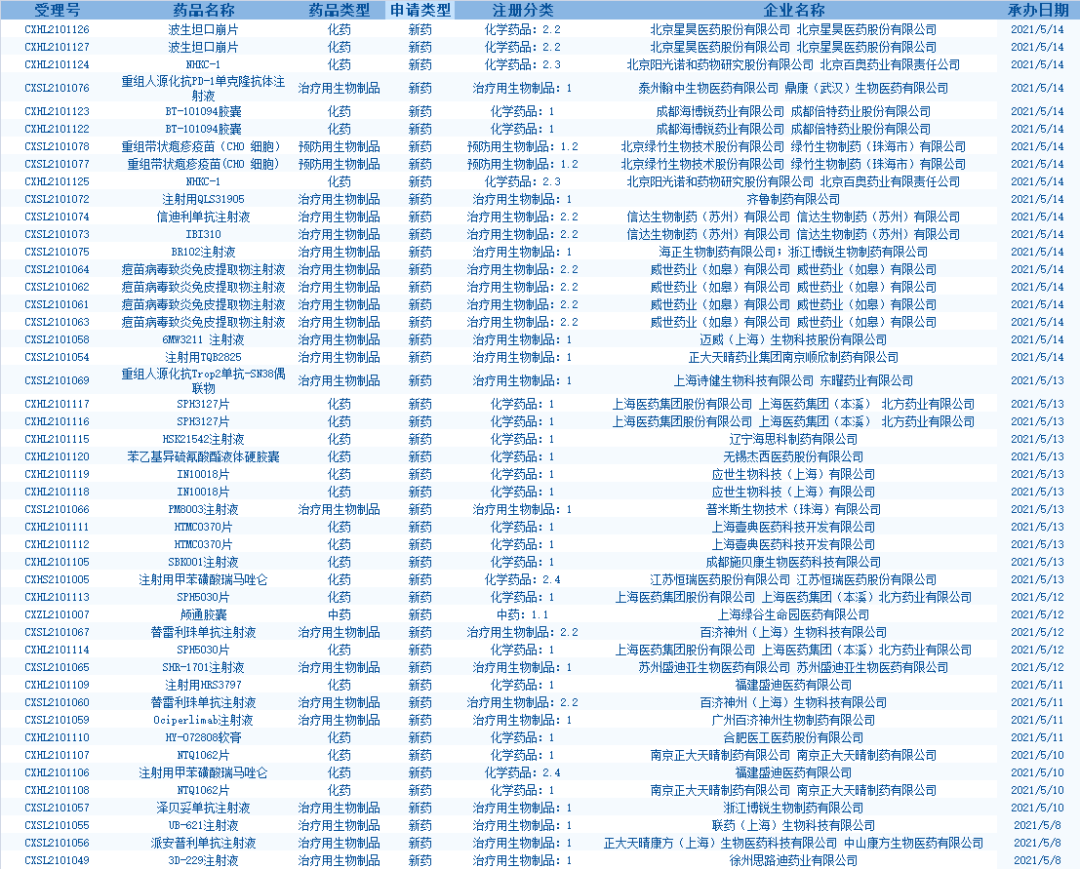
4、CDE网站公示5个拟优先审评品种。其中包括:注射用普那布林浓溶液,该药适应证为:与聚乙二醇化重组人粒细胞刺激因子联合应用,适用于成年非髓性恶性肿瘤患者化疗导致的中性粒细胞减少症(CIN),于2020年9月被纳入“突破性治疗品种”;戈沙妥组单抗,该药适应证为:用于治疗接受过至少2线既往治疗的转移性三阴性乳腺癌(TNBC)成人患者。(截至5月14日)
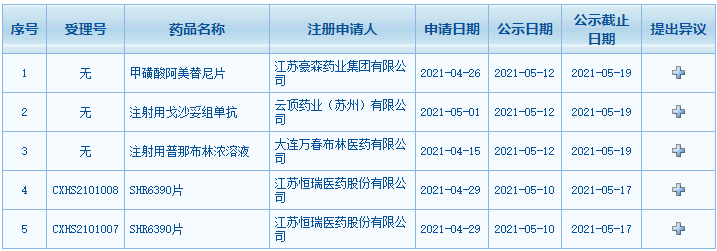
5、国家药监局医疗器械技术审评中心公示医疗器械优先审批申请审核结果,分枝杆菌鉴定试剂盒(荧光PCR熔解曲线法)属于“被列入国家科技重大专项的医疗器械”,拟定予以优先审批。
医药企业观察
1、复星医药披露公告,公司控股子公司复星医药产业拟与BioNTech(拜恩泰科)投资设立合资公司,以实现mRNA新冠疫苗产品的本地化生产及商业化。
2、日本住友制药会社中国子公司住友制药(苏州)有限公司和仑胜医药签订资产转让协议,仑胜医药将其与爱尔兰公司Nabriva Therapeutics DAC签署的lefamulin相关的许可协议等转让给住友制药。住友制药将获得lefamulin在中国的独家研发和销售权。与此同时,住友制药还将获得仑胜医药持有的Gemtesa(vibegron)、RVT-802、rodatristat ethyl在中国等的权益。
3、恒瑞医药公告,旗下卡瑞利珠单抗获国家药监局批准新适应证临床,用于治疗三阴性乳腺癌。
4、海正药业公告,旗下注射用达托霉素在美国提交的新药简略申请(ANDA)已获得FDA批准,该药将在美国市场销售。
5、Galmed Pharmaceuticals Ltd. 宣布,旗下产品Aramchol(花生酰氨基胆酸)在中国提交的新药临床试验申请(IND)已获国家药监局批准,用于治疗非酒精性脂肪性肝炎(NASH)和纤维化的III期ARMOR研究。
6、康方生物科技(开曼)有限公司宣布,其自主研发的新型肿瘤免疫治疗药物PD-1/VEGF双特异性抗体(研发代号:AK112)已完成在中国及澳大利亚等国家开展的剂量爬坡和扩展的I期临床研究,将继续开展多项单药或联合用药的临床研究,包括:单药治疗晚期非小细胞肺癌;单药治疗复发/转移性妇科肿瘤;联合化疗治疗晚期非小细胞肺癌,包含一线、PD-1/L1抑制剂治疗失败及酪氨酸激酶抑制剂(TKI)治疗失败的队列;联合化疗一线治疗广泛期小细胞肺癌;联合PARP抑制剂治疗BRCA基因野生型铂敏感复发性卵巢癌。
7、上海君实生物公告,旗下JS103注射液针对痛风适应证的临床试验申请获得国家药监局批准。
8、绿叶制药发布公告称,旗下2类新药盐酸罗哌卡因脂质体混悬注射液(LY09606)已获得CDE批准开展临床试验。
9、联拓生物与NANOBIOTIX宣布,双方就NANOBIOTIX旗下潜在首创性放射增强剂NBTXR3达成合作伙伴关系。根据协议,联拓生物将获得在大中华区、韩国、新加坡和泰国开发和商业化NBTXR3的独家授权;而NANOBIOTIX将获得2000万美元的首付款,最高可达2.2亿美元潜在的开发和商业化里程碑付款,以及NBTXR3在授权区域内的净销售分成。
10、上海睿昂基因科技股份有限公司(睿昂基因)发布招股说明书,宣布首次公开发行股票并在科创板上市。本次拟公开发行1,390.00万股,每股发行价格18.42元。
11、凯联医疗科技(上海)有限公司(凯联医疗)完成逾亿元C轮融资。本轮融资由东方富海领投,乾道投资基金及现有股东斯道资本跟投,锐翎资本作为FA协助凯联医疗本轮融资工作。
12、国家市场监督管理总局反垄断局发布信息通报:英国竞争与市场管理局(CMA)对葛兰素史克等公司反向支付行为予以处罚。通报表示英国竞争上诉法庭当日判决维持CMA对葛兰素史克公司和部分仿制药供应商违反竞争法的认定,但将CMA原来确定的罚款金额减少2,710万英镑:葛兰素史克公司的总罚款为37,606,275英镑;关于GenericsUK的违法行为,对默克公司(MerckKGaA,GenericsUK的前母公司)和GenericsUK处以5,841,286英镑的罚款;关于Alpharma的违法行为,对ActavisUKLimited,XelliaPharmaceutricalsApS和AlpharmaLLC处以总计1,542,860英镑的罚款。
药械集中采购
1、上海阳光医药采购网发布《关于开展第五批国家组织药品集中采购相关药品信息收集工作的通知》,第五批国家药品带量采购工作正式启动。此次公布的国采药品申报范围涉及60个品种共计202个品规,品种和品规数均为历次带量集采之最。
本次入围药品包括抗肿瘤药物、消化制剂、抗生素、呼吸、吸入制剂、造影剂、糖尿病药物、眼科用药、抗病毒用药等。
2、山东省公共资源交易中心发布《关于第四批国家组织药品集中采购山东中选产品挂网执行等事宜的通知》,根据第四批国家组织药品集中采购山东中选结果落地执行的工作部署,就建立配送关系、平台调整价格等事宜进行通知。
3、宁夏公共资源交易服务中心发布《关于公布2021年宁夏回族自治区(一季度)药品阳光挂网结果的通知》,对药品阳光挂网(一季度)无异议的899个药品予以公布。
文章来源:中国医药报


