医药 · 看点
《长期处方管理规范(试行 征求意见稿)》等文件公开征求意见,CDE承办受理25个新药上市申请……3月29日~4月5日,医药行业的这些事情值得关注。
行业 · 政策动态
1.国家药品监督管理局发布《根痛平片中松香酸检查项补充检验方法》《乌鸡白凤丸中拟人参皂苷F11检查项补充检验方法》和《消糜栓中拟人参皂苷F11检查项补充检验方法》等3项补充检验方法。
2.国家药监局药审中心(CDE)发布《药物免疫原性研究技术指导原则》,自3月29日起施行;发布《已上市中药药学变更研究技术指导原则(试行)》,自4月2日起施行。
3. CDE在中国药品监管科学行动计划首批重点项目“纳米类药物安全性评价及质量控制研究”中,撰写形成《纳米药物质量控制研究技术指导原则(试行)》《纳米药物非临床安全性研究技术指导原则(试行)》和《纳米药物非临床药代动力学研究技术指导原则(试行)》征求意见稿,于3月31日面向社会公开征求意见和建议,征求意见时限为自发布之日起1个月。
4.国家药监局、国家标准化管理委员会发布《关于进一步促进医疗器械标准化工作高质量发展的意见》,提出优化标准体系、强化标准精细化管理、加强标准监督实施、完善医疗器械标准组织体系、深化国际交流与合作、提升标准技术支撑能力等6类19项重点任务。
5. 国家卫生健康委组织起草了《长期处方管理规范(试行 征求意见稿)》,向社会公开征求意见,意见反馈截止时间为5月1日。
产品研发 · 上市信息
1.国家药监局发布3期药品批准证明文件待领信息,共包括187个受理号,涉及成都欧林生物科技股份有限公司等企业。(截至4月5日)


2.国家药监局发布3期医疗器械批准证明文件(准产)待领信息,共包括79个受理号,涉及聚民生物科技有限公司等企业。(截至4月5日)

3.CDE网站公示13个仿制药一致性评价任务,涉及洛索洛芬钠片等药品。(截至4月5日)
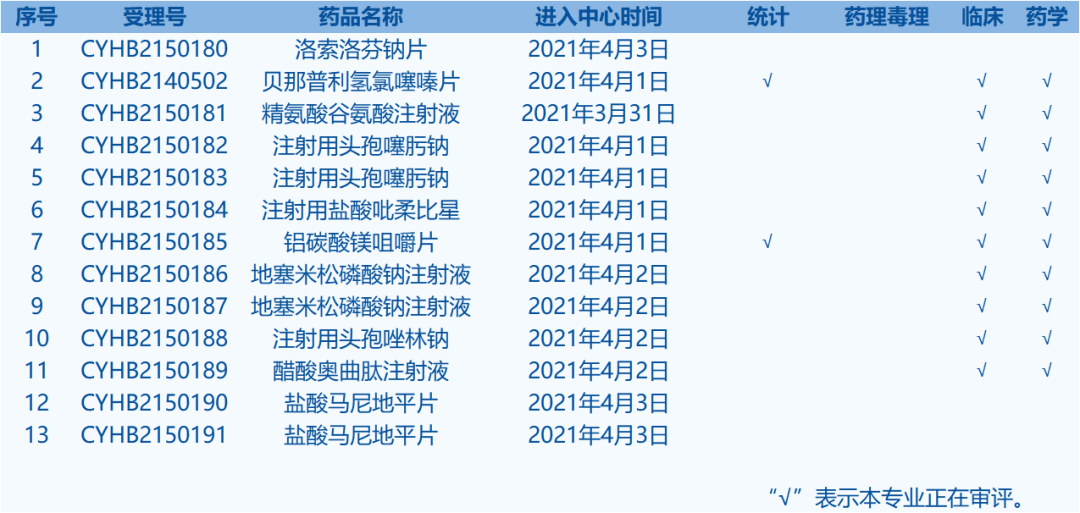
4.CDE承办受理25个新药上市申请,包括六合丹软膏等药品。(截至4月5日)

5.国家药监局器审中心公示创新医疗器械特别审查申请审查结果,胸主动脉支架系统、颅内动脉瘤手术计划软件、经导管主动脉瓣膜系统拟进入特别审查程序。
6.国家药监局器审中心公示医疗器械优先审批申请审核结果,Abbott Medical(雅培医疗)申请的动脉导管未闭封堵器因专用于儿童,且具有明显临床优势,符合优先审批情形,拟定予以优先审批。
医药企业观察
1.罗氏制药中国与青岛百洋医药共同宣布,双方将合力探索肿瘤领域的合作。罗氏制药将旗下两大肿瘤药产品希罗达®(卡培他滨片)和特罗凯®(盐酸厄洛替尼片)在中国大陆地区的市场推广权授予百洋医药,双方将共同推进肿瘤药市场布局,提升产品可及性。
2.广州白云山医药集团股份有限公司发布公告称,其控股子公司广州医药股份有限公司已向香港联交所递交了发行上市申请,以申请广州医药于香港联交所主板上市及买卖。
3.复宏汉霖宣布与苏州润新生物科技有限公司就BRAF V600E抑制剂RX208达成一项独家许可合作,复宏汉霖获得该产品在中国进行研究、开发、生产和商业化等的独家权利。润新生物将获得9750万元的首付款,最高可达约10.8亿元的相关临床开发、注册和销售里程碑付款,以及产品上市后的销售提成。
4.药明生物技术有限公司计划与无锡药明康德新药开发股份有限公司的附属公司上海合全药业股份有限公司成立合资公司WuXi XDC (Cayman) Inc.(WuXi XDC)。WuXi XDC将从事抗体偶联药物(ADC)及其他生物偶联药物的合同开发与生产,药明生物及合全药业拟将分别向其注资1.2亿美元及0.8亿美元。
药械集中采购
1.四川省药械招标采购服务中心发布关于做好医药机构药品集中采购工作的通知。通知指出,经国家药监部门批准,在我国境内上市的药品均可申请挂网。集采中选产品按照集中带量采购文件要求执行,非中选产品增补周期参照价格联动采购药品执行。价格联动采购药品实行常态化挂网,原则上每月集中申报一次,具体时间另行通知。备案药品原则上随时申报,每月集中增补一次。
2.天津市医药采购中心发布京津冀“3+N”联盟药品联合带量采购项目文件,11个品种被纳入,涉及24个品规,全部为口服品种,包括替米沙坦氢氯噻嗪口服常释剂型、二甲双胍格列吡嗪口服常释剂型以及复发利血平口服常释3个复方制剂。
3.湖南省公共资源交易中心发布关于开展2021年第二轮省际价格联动工作的通知,共涉及同通用名、剂型无挂网的备案药品11516个,同通用名、剂型有挂网的备案药品共有12660个。另外,氯化钠等4类基础大输液类药品不纳入本次价格联动范围。
文章来源:来自中国医药报


